添加日期:2017年10月19日 阅读:1587
10月19日讯 两办《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)于10月8日向社会全文公布;10月9日,CFDA举行新闻发布会进行解读。其中,注射剂再评价是业界*关注的热点——毕竟注射剂占据了我国药品市场的半壁江山,注射剂再评价事关千亿市场。
根据政策要求,力争在5~10年完成注射剂再评价。然而,注射剂再评价的方法学研究仍在探索阶段。现在能确定的是,过去已批准上市的注射剂的再评价,需要在批准上市时的研究情况、上市后持续研究情况等综合分析的基础上,开展产品成分、作用机理和临床疗效研究,评估其安全性、有效性和质量可控性。
注射剂特别是静脉注射剂,属于高风险剂型。注射剂再评价*难执行的两类产品主要是多组分生化药注射剂和中药注射剂,这两类药品早期上市的上市研究普遍缺乏临床有效性和安全性数据,并且不良反应率较高和有效成分复杂,导致公众对这两类产品的安全性和有效性的担忧。
近十年政策方向:
不停在提升质量,特别是有效成分含量纯度
实际上,自2007年起,CFDA都要求中药注射剂和多组分生化药注射剂生产企业改进工艺,提升质量。如表1所示,2010年颁布的《关于印发中药注射剂安全性再评价生产工艺评价等7个技术指导原则的通知》就颁布了中药注射剂安全性再评价的生产工艺、质量控制、非临床研究、临床研究、风险控制、效益与管理的技术原则。
表1 近十年CFDA发布的中药注射剂和多组分生化药注射剂相关政策
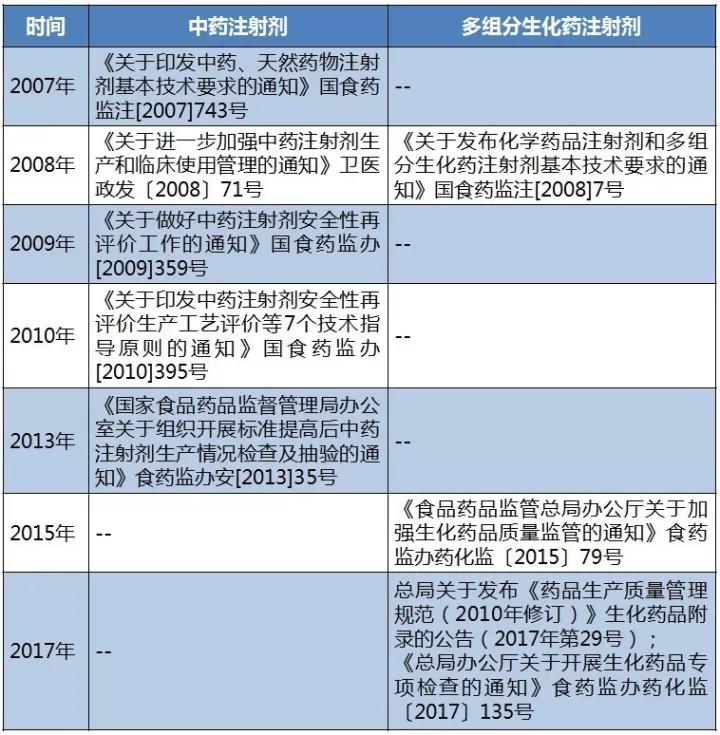
(来源:识敏信息)
无论是中药注射剂,还是多组分生化药注射剂,都是在保证安全性的方向下追求质量标准的提升,特别是对有效成分的标定与含量纯度的提高。如表2所示,近五年一直有多组分生化药注射剂变更质量标准,相关生产企业普遍都将标定成分含量纯度提升到80%以上。
表2 多组分生化药注射剂近五年质量标准提升情况
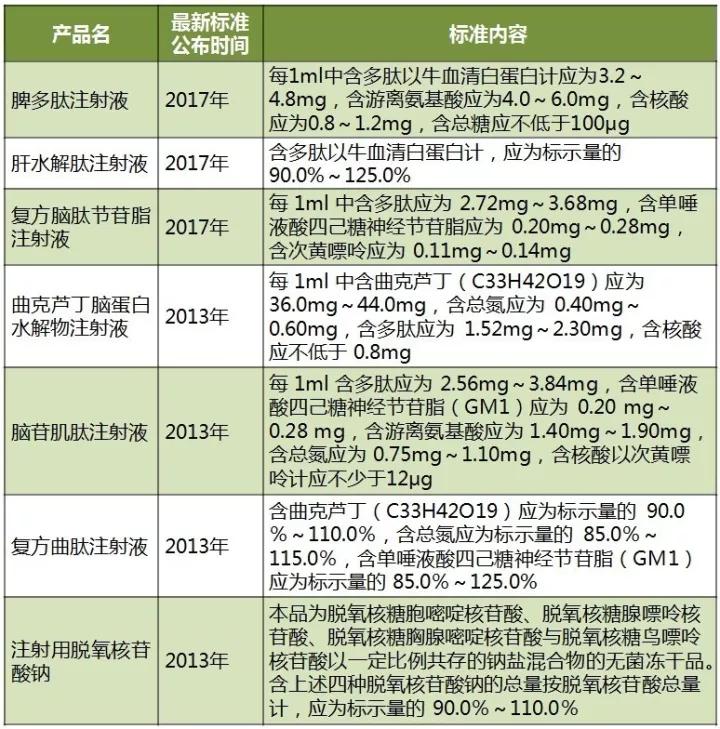
(来源:识敏信息)
中药注射剂目前的科技资金投入主要包括改进生产工艺、提高质量标准、增加临床用药合理性与针对性、降低不良反应的发生率。以动物模型为代表的实验室基础研究、药物临床研究、制备工艺与配方研究是三大热点研究领域。
2013年以来,中药注射剂和多组分生化药注射剂在CDE药物临床试验平台登记Ⅳ期的项目并不多。中药注射剂做上市后再评价主要有2011年以后上市的银杏内酯注射液、注射用丹参多酚酸和银杏二萜内酯葡胺注射液,研究的方向也是以安全性为主。有效性研究相对较少,已上市的Ⅲ期临床主要是为了增加适应症,如热毒宁注射液治疗流行性感冒高热的有效性及安全性的Ⅲ期临床。
综上所述,以往中药注射剂和多组分生化药注射剂的研究是基于安全性目标提升有效成分的含量纯度,但是安全性高不代表该药有效。有效性是药品的根本属性,如果没有疗效药品就没有价值,在CFDA举行的审评审批制度改革鼓励药品器械创新发布会中就明确提出了“中药注射剂的评价首先是评价有效性,同时也要审查安全性”。这意味着CFDA对个别注射剂的“安全无效”说“不”,又一次提升了对中药注射剂和多组分生化药注射剂的要求。
有效性研究的必要性:
摆脱辅助用药政策影响,是生存和保市场的必选项
2015年2月,国务院办公厅颁布的《国务院办公厅关于完善公立医院药品集中采购工作的指导意见》提到,要“加强医务人员合理用药培训和考核,规范医生处方行为,切实减少不合理用药。建立处方点评和医师约谈制度,重点跟踪监控辅助用药、医院超常使用的药品。”
2017年,医院基本都执行了药占比限制30%的规定和重点监控药物使用量限制的规定,并且2017年新版医保目录对部分中药注射剂和多组分生化药注射剂的临床机构级别和适应症方面都有所限制,这些因素无疑会导致中药注射剂和多组分生化药注射剂的市场规模增长陷入停滞。
以中恒的血栓通为例,新版医保目录发布后各省市二级以下(不含二级)医保基层报销受限,2016年度血栓通销售收入13.83亿元,二级以下医疗机构销售占比30%。2017年上半年,血栓通销售收入8.05亿元,二级以下医疗机构销售占比29.8%。在政策从严的大环境下,预计2018年1月起,全国会全面执行新的医保目录,根据各省份经济情况不同,部分省份执行过程中受限政策可能会有所调整,而中恒预计对血栓通2018年销售影响占比5%~15%。
国家对于辅助用药的监管,不仅是医保准入更为严格、用药限制更为明确,还有支付比例逐渐降低。鉴于此,中药注射剂和多组分生化药注射剂也需要通过有效性临床验证数据来保住市场。
中药注射剂和多组分生化药注射剂的适应症较多,考虑现有临床研究的成本,生产企业若要开展有效性临床研究,首先要做的就是适应症筛选,通过市场分析和产品过往的临床数据聚焦适应症,选择一个*有把握的适应症启动临床研究。
对此,可参照马来酸桂哌齐特注射液上市后再评价。马来酸桂哌齐特注射液是CFDA点名要开展上市后临床研究的。马来酸桂哌齐特注射液的适应症很多,为“脑血管疾病:脑动脉硬化、一过性脑缺血发作、脑血栓形成、脑栓塞、脑出血后遗症和脑外伤后遗症;心血管疾病:冠心病、心绞痛;外周血管疾病:下肢动脉粥样硬化病、血栓闭塞性脉管炎、动脉炎、雷诺氏病等”。而基本所有企业都选择了急性缺血性脑卒中这一适应症。
小结>>>
注射剂再评价将影响不少过亿品种的蛋糕,企业以往的研究主要是基于安全性的质量,有效性临床的数据更多体现在临床观察的中文论文上。中药注射剂和多组分生化药注射剂有效性研究预计要花5~10年甚至更长的时间,因此对产品淘汰的影响将会是个漫长的过程。
对生产企业来说,中药注射剂和多组分生化药注射剂近期挑战主要还是不良反应的监控、飞行检查和工艺核对所带来的生存压力。
文章来源:
1.凡本网注明“来源:1168医药招商网”的所有作品,均为广州金孚互联网科技有限公司-1168医药招商网合法拥有版权或有权使用的作品,未经本网授权不得转载、摘编或利用其它方式使用上述作品。已经本网授权使用作品的,应在授权范围内使用,并注明“来源:1168医药招商网http://www.1168.tv”。违反上述声明者,本网将追究其相关法律责任。
2.本网转载并注明自其它来源(非1168医药招商网)的作品,目的在于传递更多信息,并不代表本网赞同其观点或和对其真实性负责,不承担此类作品侵权行为的直接责任及连带责任。
3.其他媒体、网站或个人从本网转载时,必须保留本网注明的作品第一来源,并自负版权等法律责任。
4.如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。联系邮箱:1753418380@qq.com。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。

【适用范围】用于缓解颈、肩、腰、腿及闭合性软组织疼痛、肿胀等不适症状人群的物理冷敷。【使用方法】外用。将本品适量直接涂抹于不适部位,轻轻按摩2-3分钟,每日2-3次。
 粤公网安备 44011102000390号
粤公网安备 44011102000390号